臓器移植医療部

臓器移植医療部は2001年4月に国立大学病院としては京都大学に次いで全国で2番目に、移植医療の定着と発展を目的として設置されました。
開設当初より北海道における臓器移植希望患者(肝臓、膵臓、小腸)に対して手術・術後フォローはもとより術前(待機中)から専門的な治療を行ってきました。
臓器移植医療部長のあいさつ

2011年から部長を肝臓・膵臓・小腸移植担当の嶋村剛が務め、同時に腎移植担当医(堀田記世彦)と心移植担当医(大岡智学)をおのおの泌尿器科と循環器外科から副部長に招え、肺以外の全ての臓器移植に対応できる体制となりました。
また、移植医療で重要な役割を果たすレシピエント移植コーディネーターとして、肝臓・膵臓・小腸移植を担当する山本真由美・柏浦愛美、腎臓移植を担当する高田めぐみ、心臓移植を担当する櫛引勝年・加藤美香が在籍し、北海道大学病院における臓器移植全般の窓口となっています。
移植手術に際しては多くのマンパワーが必要であり、外科・泌尿器科・手術部・集中治療室・ME機器管理センター・病理部・検査部など多岐にわたる関連各科との協力が重要となります。その協力体制を構築する中枢ともなっています。
肝臓・腎臓ではこれまで多くの生体移植を実施してきましたが、2010年7月の臓器移植法改正を契機に、脳死下での臓器提供数がそれまでの約10倍となり、年間80~90例になりました。生体移植のみならず、脳死移植においても移植医療の尊厳性・公平性・透明性を維持しながら全員で対応して参ります。
スタッフ
- 部長・診療教授(専任):嶋村 剛
- 副部長・講師(兼任):堀田 記世彦
- 副部長・助教(兼任):大岡 智学
- 副看護部長:鹿内 三起子
- 看護師長:中野 政子
- レシピエント移植コーディネーター(肝臓・膵臓・小腸)・副看護師長:山本 真由美
- レシピエント移植コーディネーター(肝臓・膵臓・小腸):柏浦 愛美
- レシピエント移植コーディネーター(腎臓):高田 めぐみ
- レシピエント移植コーディネーター(心臓):櫛引 勝年
- レシピエント移植コーディネーター(心臓):加藤 美香
北海道大学病院で実施できる移植手術

北海道大学病院は脳死下臓器提供に基づく心臓・肝臓・膵臓・小腸移植の道内で唯一の実施認定施設です(腎臓のみ他施設も認定されています)。これにより、
- 脳死ドナーからの心臓移植・肝臓移植・腎臓移植・膵臓移植・小腸移植
- 心停止後に提供された臓器を用いた腎臓移植・膵臓移植
- 健康なご家族から臓器の一部を提供頂き実施する生体肝臓移植・生体腎臓移植
を行っています。また、2020年3月に膵臓の一部(膵島)のみを移植する施設としても認定されました。
対象となる疾患・実施数・待機患者数・成績(北海道大学病院ならびに全国平均)・手続き・生体ドナーの条件・担当スタッフについては各臓器の項をご参照ください。
腎臓移植部門
はじめに
腎臓は体内の老廃物を排泄し、水分や電解質の調整をしている臓器で有り生命維持に不可欠な臓器です。腎臓の機能不全(慢性腎不全)となってしまった場合には腎代替療法が必要になります。腎代替療法には血液透析、腹膜透析に加え唯一の根治療法である腎移植があり、生命予後の延長に寄与すると言われております。また、移植した腎臓の維持には免疫抑制剤を内服しなくてはなりませんが、食事や生活の制限が透析療法に比べ極めて少ないため生活の質(QOL)の向上も期待できます。この様に慢性腎不全患者さんに推奨される治療ではありますが、我が国における腎移植の認知度はまだまだ低く、実際に慢性腎不全患者さんの大多数が血液透析を受けているのが現状です。臓器移植医療部では腎移植を一般の医療として提供すると共に、社会への啓蒙にも努めております。
対象患者さん
慢性腎不全の原因となる全ての疾患が対象となり、IgA腎症、巣状糸球体硬化症、腎硬化症、常染色体優性多嚢胞腎など様々です。以前は対象外であった糖尿病性腎症に対しても現在は行っており、I型糖尿病に対しては膵臓移植グループと共同で膵腎同時移植を行っております。また、道内で唯一小児腎不全患者に対しても腎移植を行っております。特に体重が15kg以下の低体重児の腎移植は難易度が高く日本全国でも数施設しか行っておりませんが、北海道大学病院では小児科腎グループとの連携により積極的に行っております。
以前は血液型が一致していない腎移植(血液型不適合)は不可能でしたが、現在では手術前に特別な処置は必要とするものの血液型が一致する移植と同等の成績となっております。腎移植前に透析療法を施行されていないと腎移植は出来ないと言う誤解がありますが、透析療法を施行せずに行う腎移植(先行的腎移植)は透析療法を行った後に腎移植をするよりも成績は良く積極的に勧めております。
腎移植には健康な親族から腎臓を提供して頂く生体腎移植と、亡くなった方から提供して頂く献腎移植があり親族に提供者がいなくても腎移植が可能です。
移植件数と成績
北海道大学病院では1965年より腎移植が始まり、2019年度までに436例にのぼり、生体腎移植が377例、献腎移植が59例行われております。2019年には34件の腎移植が行われております(図1)。
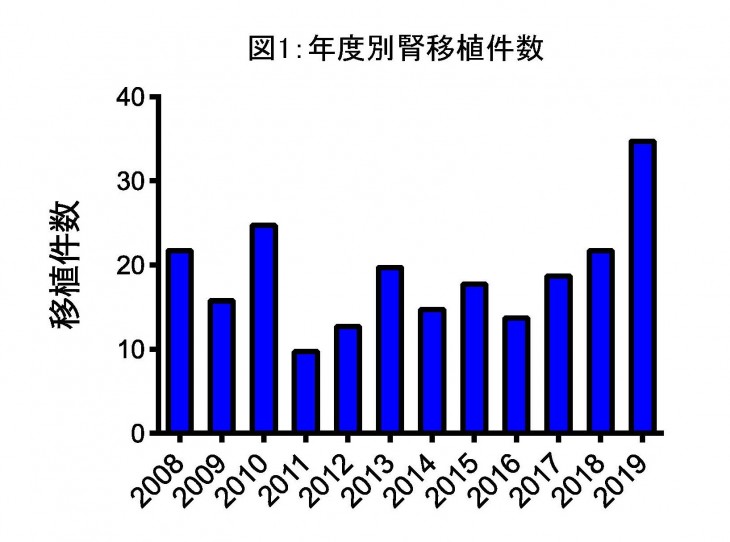
生体腎移植では腎提供をして頂く方(ドナー)の負担を軽減するために2001年より鏡視下手術を行っており、通常1週間程度で退院し社会復帰しています。現在まで180例の方に施行され、輸血を要した症例が2症例(0.9%)、手術後に再手術が必要になった症例が2症例(0.9%)おりましたが退院後に後遺症が残った方はおりません。
腎移植の成績については、1965年から1985年までの期間では使用出来る免疫抑制剤が限られており頻繁に拒絶反応が発症したことから10年生着率20%程度と満足のいく成績ではありませんでした。しかし、その後の免疫抑制剤や検査方法の発達により徐々に成績は向上し現在の10年生着率は生体腎移植で約90%、献腎移植で約80%まで改善致しました(図2、図3、図4)。
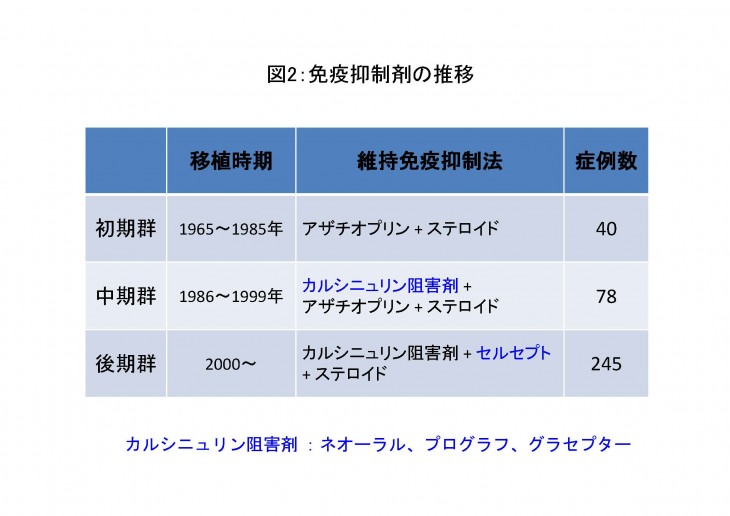
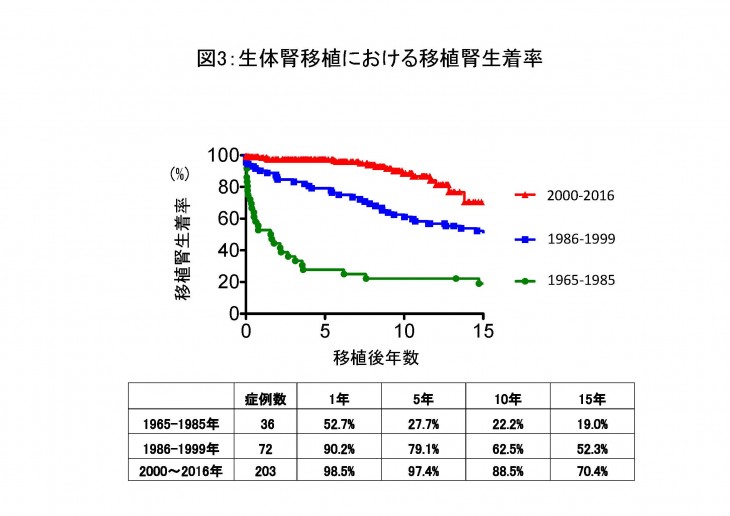
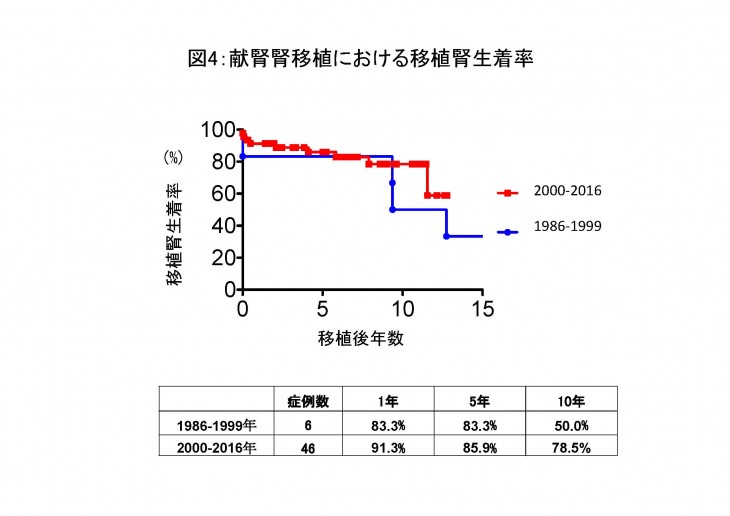
この要因としては現在の免疫抑制剤により急性拒絶反応の発症が激減したことがあげられます。一方で移植後10年を超えると慢性拒絶反応により移植腎機能が悪化する症例を認めるのが現在の課題です。当院ではこの慢性拒絶反応の早期発見や新規治療法の開発を目的に研究を進めております。
腎移植までの流れ
腎移植を行うにあたり莫大な医療費の負担が必要だと思われている方も多いですが、健康保険が適応される医療で有り自己負担は多くはありません。腎移植を希望される方、または腎移植のお話しを伺いたい方は主治医の先生に診療情報提供書を書いて頂き当院泌尿器科を受診して頂きます。予約診療となりますので、当院泌尿器科外来へご連絡頂ければ、移植コーディネーターが予約の手順をご説明致します。初診時には、持参された診療情報提供書に基づき生体、献腎移植の説明をさせて頂きます。
献腎移植の場合、日本臓器移植ネットワークへの登録が必要です。必要な検査を行った後、移植可能と判断された場合に登録となり、登録後は1年に一回移植施設への外来受診が必要です。待機期間が10年以上と長いことが問題となっております。
生体腎移植の場合は、腎提供が可能な方は自発的な提供の意思のある親族(6親等の親族と3親等の姻族)です。移植を受ける方、提供される方ともに少なくとも数回の外来受診が必要です。
予約方法、その他のお問い合わせ先
北海道大学病院 泌尿器科外来 011-706-5772(直通)
平日午前9時〜午後4時
患者様またはご家族の方、医療関係者の方からの質問をお受けしていますのでお気軽にお問い合わせ下さい。
スタッフ紹介
泌尿器科ホームページ
http://toms.med.hokudai.ac.jp/
消化器移植部門
肝臓移植
はじめに
肝臓は心臓・肺と同様に生命維持のために必要な臓器です。肝臓なしでは人間は生きていくことができません。肝臓は解毒・代謝・タンパクの合成に加え、免疫力にも関与しており、その複雑な機能のため代用臓器(人工肝臓)は実現に至っておりません。
そのため、種々の原因で末期肝不全に陥った患者さんを救命する唯一の方法が肝臓移植です。肝臓移植は1963年に米国の医師Starzlによって初めて行われました。残念ながら初期の患者さんは救命することができませんでしたが、試行錯誤を重ね1967年に初めて成功しました。その後、免疫抑制剤の進歩・手術技術の向上を背景に長期生存が可能になり、今では全世界で行われています。
日本では1989年より血縁者・配偶者から肝臓の一部を提供して頂く、生体肝移植が行われています。世界的には脳死下の臓器提供(脳死肝移植)が主流ですが、日本ではその開始が1997年(臓器移植法(旧法)施行)と遅れたため、いまも諸外国に比べ実施数が少なく、現在でも生体肝移植が多くを占めているのが現状です。しかし2010年の臓器移植法改正後、脳死肝移植は増加傾向にあり、日本全体で年間約50例の脳死肝移植が行われるようになってきました。すなわち、肝移植を希望された場合は主治医と相談しながら、生体肝移植・脳死肝移植のいずれかを選択することになります。
日本における肝移植数
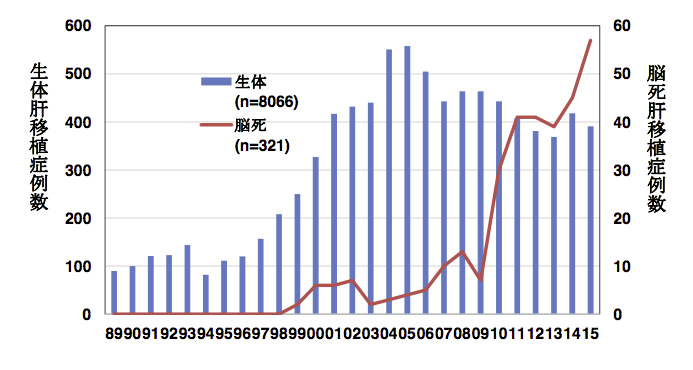
対象疾患
肝臓移植の対象疾患は多岐にわたりますが、「他の治療法で救命できない末期肝不全」「進行例を除く肝臓癌」「劇症肝炎」や「肝臓を置き換えることによって病気の進行を食い止められる先天性代謝疾患」などになります(下表参照)。
対象疾患のほかに、移植を受けられる方の年齢に制限を設けており、脳死肝移植の場合:登録は65歳まで(実施は70歳まで)、生体肝移植の場合:原則として70歳までとしています。
| 成人 | 小児 | |
| 先天性肝・胆道疾患 | α1アンチトリプシン欠損症 | 胆道閉鎖症 アラジール症候群 バイラー病 |
| 慢性肝疾患 | ウイルス性肝炎(HBV/HCV) 原発性胆汁性胆管炎(PBC) 原発性硬化性胆管炎(PSC) 自己免疫性肝炎(AIH) 非アルコール性脂肪肝炎(NASH) アルコール性肝炎(条件付き)*1 二次性胆汁性肝硬変 |
|
| 急性肝疾患 | 劇症肝不全 | 新生児肝炎 劇症肝不全 |
| 代謝性肝疾患 | 家族性アミロイドポリニューロパチー(FAP) Wilson病 ヘモジデローシス ヘモクロマトーシス |
Wilson病 OCT欠損症 シトルリン血症 チロシン血症 など |
| 腫瘍性肝疾患 | 肝細胞癌*2 多発性嚢胞肝 神経内分泌腫瘍(肝転移) |
肝芽腫 |
| 血管性肝疾患 | バッドキアリ症候群 |
*1 原則として、脳死肝移植の登録には1年半以上の断酒、神経科による診察が必要となります。
*2 保険診療内で肝移植を行う場合、遠隔転移と血管内浸潤を認めないもので、①腫瘍の最大径5cm以下かつ腫瘍数1個、または②腫瘍の最大径3cm以下かつ腫瘍数3個以内、という条件が付きます
肝移植症例数
当院では1991年12月から2020年3月までに323例の肝移植(下左表. 生体肝移植 270例(ドミノ肝移植2例を含む)、脳死肝移植58例)を実施しました。一方で2020年3月現在、当院での脳死肝移植待機中の肝不全患者さんは40名となっています(下右表)。
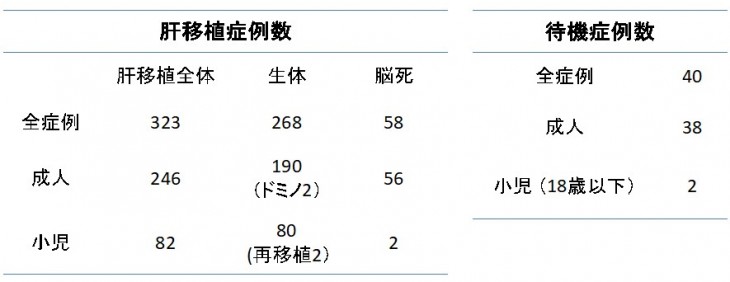
肝移植の成績
以下に成人生体肝移植、小児生体肝移植、脳死肝移植の成績を示します。当院(1998年〜2020年3月)の成績と全国平均をグラフ横のテーブルで比較しています。全症例の平均はいずれも全国平均より良好ですが、特に近年は手術手技、周術期管理の確立に伴い成績が向上しています。
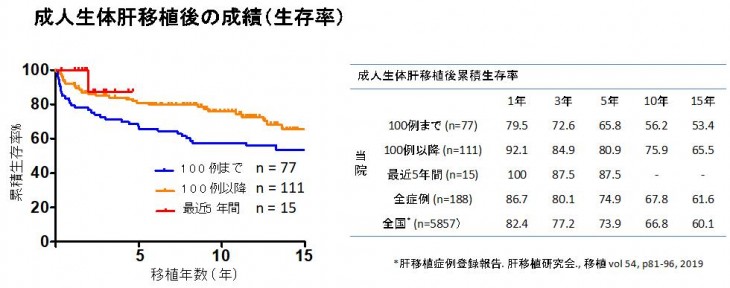

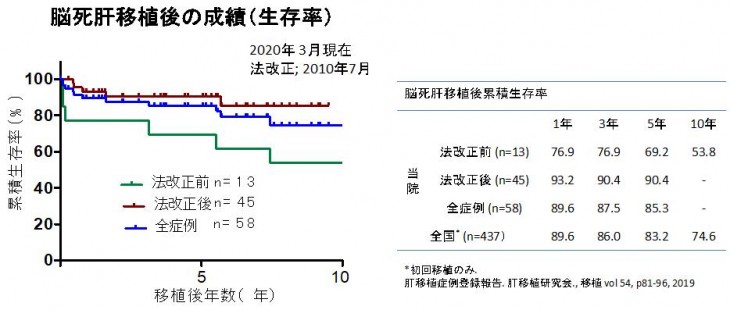
生体肝移植の流れ
1.手続き
- 肝移植の適応と判断される場合、北海道大学病院の肝移植外来の初診を受診します。主治医の先生から北海道大学病院地域連携の窓口を通してご紹介ください。当院の移植コーディネーターが初診の日程を調整します。
- 初診では肝移植についてまず肝移植の担当医師から説明します。最初に肝移植について説明したDVDを閲覧して頂きます。初診を受ける皆さん全員にみてもらいます。肝移植の手術は肝臓の提供者(ドナーといいます)のご家族と、移植後の長期にわたるリハビリを含め頂いた臓器を失わないために、ご家族全員の協力が重要になります。患者さんに関係のある多くのご家族に初診に来てもらうことを勧めています。
- 生体肝移植の場合、家族にドナーがいないと成り立ちません。北海道大学病院では、生体ドナーは以下の条件を満たすことが原則必要です。ただし血液型が適合または一致以外(不適合)の組み合わせの場合など、患者さんによって検討することがあります。

- 初診で移植について話を聞いた後、ご家族で話し合ってもらいます。生体肝移植の場合、ドナー希望の方から後日、移植コーディネーターに連絡をしてもらいます。
- 生体ドナー希望の方が、上記条件を満たしているか診察します。採血などで健康に異常がないことを調べます。
- 次にCT検査で肝臓のサイズや血管に異常がないことを確認します。ドナーに十分な肝臓が残り、レシピエントにとっても十分なサイズの肝臓が提供されることが必要で、それを詳しく調べるために数日の検討が必要になります。
- ドナー候補者の年齢、既往などにより、心臓の検査、上下部内視鏡検査、肝生検が追加検査として必要になることがあります。
脳死肝移植の登録について
1.手続き
脳死肝移植を受けるためには、日本臓器移植ネットワークに脳死肝移植希望患者として登録する必要があります。登録の流れは以下の通りになります。
- 主治医(内科、小児科)と御相談頂き、移植施設(脳死肝移植実施施設)を決定します。
- 主治医の紹介のもと、移植施設を受診します。
- 移植施設にて精査を行い、日本臓器移植ネットワークへの登録申請を行います。
- 医学的要件が脳死肝移植の適応基準を満たさなかった場合、または脳死肝移植の非適応要件が見つかった場合、登録ができないことがあります。
- 登録申請が認可されると、日本臓器移植ネットワークより新規登録料の払い込み用紙が送られてきます。登録料の払い込みが終了した時点で、登録完了となります。
- 登録が完了すると、「臓器移植希望登録証」が送られてきます。
2. 登録に関する費用
新規登録時に登録料3万円がかかります。以降は年に一度の更新時(毎年3月)に登録更新料として5千円かかります。
膵臓・膵島移植
はじめに
膵臓移植は1966年に米国ではじめて実施され、現在では1型糖尿病に対する根治的治療法として確立しています。膵臓移植後はほとんどの患者さんで血糖値が安定し、インスリンの注射が不要となります。膵臓と一緒に腎臓も移植した場合は、血液透析などの腎代替療法からも解放されます。免疫抑制剤の進歩や、手術手技の向上とともに、移植成績は年々改善しています。
1型糖尿病に対する移植による治療法としては、“膵島移植”という方法もあります。膵島移植では、膵臓からインスリンを分泌するβ細胞(膵ランゲルハンス島ともよばれます。)のみを単離精製し肝臓内に移植します。点滴の要領で移植が行われるため、体への負担が極めて少ないというメリットがあります。膵島移植後は使用するインスリン量が減少し、無自覚低血糖発作が減少します。本年、膵島移植はようやく保険適応となりました。北海道大学病院は、このたび膵島移植を目的とした膵島分離・移植施設として承認されました。
膵臓移植
対象疾患
対象となる患者さんは、以下の①または②のいずれかに該当する方です。
- 腎不全となった1型糖尿病患者さん
- インスリンを用いたあらゆる治療を行っても血糖値が不安定で、代謝コントロール不良の状態が長期間継続している1型糖尿病の患者さん
①の場合には、すでに腎臓移植を受けていてもよいし、これから腎臓移植と一緒に膵臓移植を受けることも可能です。①、②いずれの場合も、膵臓単独での移植が可能です。年齢は原則として60歳以下が望ましいとされています。合併症、または併存症による制限として、糖尿病性網膜症の病態が安定していること、感染症や肝機能障害、消化性潰瘍がないこと、悪性腫瘍があった場合には治療終了後5年が経過し、この間再発がなく根治していると判断できること、などが挙げられています。
症例数
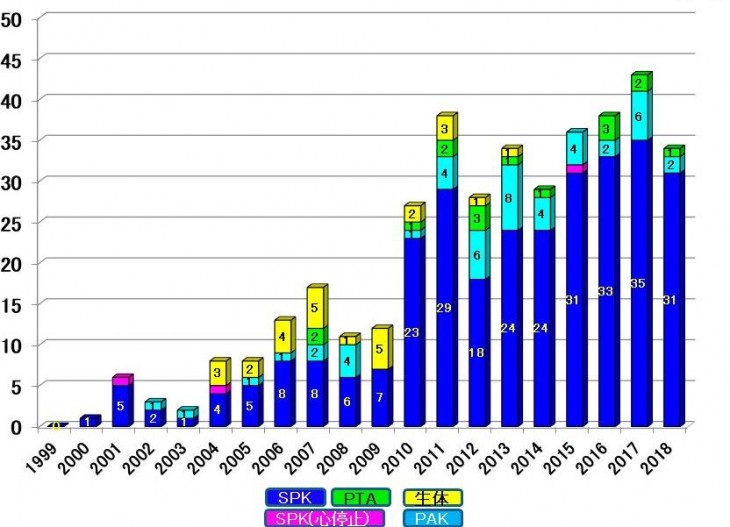
本邦では1984年の第1例目以降、1997年の臓器移植法施行前までに15例の膵臓移植(脳死1例、心停止14例)が行われました。2000年から2019年までに累計446例、年間30例前後の膵臓移植が実施されています。ています。膵臓移植は腎臓移植との関係により、膵腎同時移植(SPK)、腎移植後膵移植(PAK)、膵単独移植(PTA)の3つのカテゴリーに分類されます。本邦ではSPKは約81%、PAKは約15%、PTAは約4%の割合で実施されており、世界的に見ても膵臓移植の約80%がSPKとして実施されています。移植する膵臓(グラフトといいます)は脳死となったドナーさんから提供していただくことが原則で、生体膵臓移植は限られた施設でしか施行されておりません。北海道大学病院では2005年よりこれまで9例の膵臓移植(SPK6例、PAK3例)を実施し、全例が脳死ドナーからの臓器提供を受けての膵臓移植でした。移植された膵臓は移植後すみやかに機能し、インスリンの投与が不要となりました。
手術
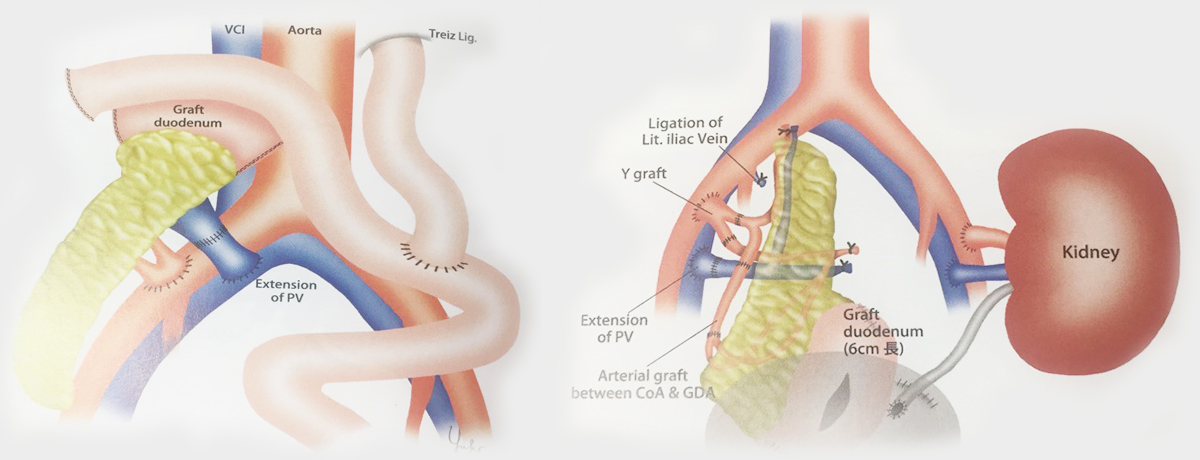
手術は全身麻酔で実施し、SPKの場合はおよそ8時間前後の手術時間を要します。膵臓グラフトは通常右の腸骨窩(お腹の右下部位)に移植し、同時に腎臓を移植する場合には反対側(通常は左の腸骨窩)に腎臓を移植します。吻合に使用するための自身の血管(腸骨動静脈)を露出し、膵グラフトの血管と自身の血管とを吻合します。膵臓からはインスリン以外にも消化酵素を含む膵外分泌液が分泌されるため、膵グラフトに付属している十二指腸を自分の腸とつなぐ(腸管ドレナージ法)か、または自分の膀胱とをつなぐ(膀胱ドレナージ法)かのいずれかの方法で、膵外分泌液を排出させます。手術後は集中治療室に入室します。
成績
膵臓移植をうけた患者さん全体での5年生存率は95%、膵グラフト生着率は75%です。移植別に見た5年後の膵グラフト生着率は、SPKは82%、PAK/PTAは36%でした。北海道大学病院で実施した膵臓移植患者さんは膵移植後直ちにインスリンから離脱し、血糖値が安定しました。
手続き
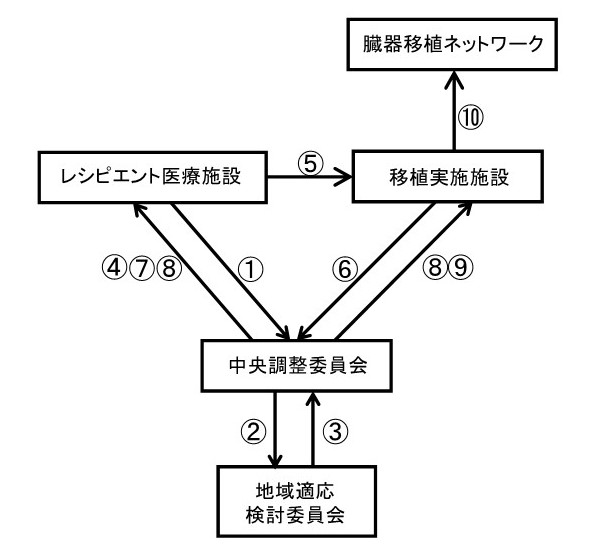
膵臓移植の希望がある場合、まずレシピエント医療施設(北海道大学内科II)で入院検査を実施した後に、中央調整委員会に適応判定申請書を提出し審議されます(①②)。移植適応ありと判断されると、移植可の意見書がレシピエント医療施設に送付され(③④)、この結果を受けて、レシピエント医療施設は移植実施施設(北海道大学消化器外科I)に対し移植可否の意見書を依頼します(⑤)。移植の可否報告が中央調整委員会、レシピエント医療施設に報告され(⑥⑦)、移植可であれば、中央調整委員会は事務登録を行い、レシピエント医療施設および移植実施施設に報告となります(⑧)。中央調整委員会は移植実施施設に対し日本臓器移植ネットワーク登録用紙と振込用紙を送付し(⑨)、移植実施施設の担当医が日本臓器移植ネットワークに登録し、待機が開始となります。
膵島移植
対象疾患
膵島移植の適応疾患は、1型糖尿病です。本年、膵島移植はようやく保険適応となり、さらに北海道大学病院は、このたび膵島移植を目的とした膵島分離・移植施設として承認されました。具体的な移植の条件や、方法等については現在検討中の段階ですが、北海道大学病院で膵島移植をいち早く実施できるように、準備を進めています。
小腸移植
はじめに
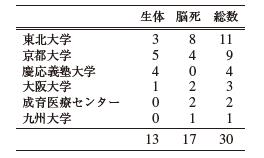
小腸移植は1964年にアメリカ・ボストンでDeterlingらによって初めて実施されました。小腸には多くの免疫組織が存在し、他の臓器に比べて拒絶反応が強く起きる特徴があります。そのため強い免疫抑制療法が必要になりますが、逆に易感染性となるため感染症に注意しなければなりません。効果的な免疫抑制剤とあわせ強力な抗菌剤・抗真菌剤・抗ウイルス剤が開発されたことで移植後の成績も改善していますが、臓器移植の中では最も難しい管理が要求されます。現在、日本で脳死小腸移植の認可を受けている施設は(北から南へ)北海道大学、旭川医科大学、東北大学、国立成育医療センター、自治医科大学、慶応大学、名古屋大学、大阪大学、京都大学、岡山大学、九州大学、熊本大学の12施設となっていますが、実際に手術を実施した施設は6施設(実施数の多い順番に東北大学、京都大学、慶応大学、大阪大学、国立成育医療センター、九州大学)に限られています。 表:日本で実施された小腸移植(実施施設と実施数)
対象疾患
小腸は食物(栄養素)の消化・吸収に必須の臓器ですが、これが先天的あるいは後天的(事故や腸管の血栓症など)に短い場合に小腸移植を考えることになります。また、長さが十分であっても、その機能が十分でない場合にも適応になります。ただ、医療の進歩により口から全く栄養素を摂らなくても(小腸での吸収を考えなくても)、中心静脈栄養(点滴による栄養補給)で十分な栄養素が投与できるようになりました。実際は、この静脈栄養のための血管ルートが確保できなくなった場合や長期間の点滴による栄養補給により肝臓に負担がかかり肝臓の機能が低下した場合(肝硬変など)に手術が実施されています。肝不全を合併した患者さんに対しては、2011年から肝臓移植と小腸移植の登録が同時に可能となり、肝臓の提供を受けられれば優先的に小腸の提供も受けられることになりました。一方、長期間にわたる静脈栄養ルート確保の方法として最近エタノールロックという方法が開発され、さらに肝臓の機能低下を抑制する魚油の点滴(オメガベン®)が開発されたことで、移植を回避できる症例も増えています。
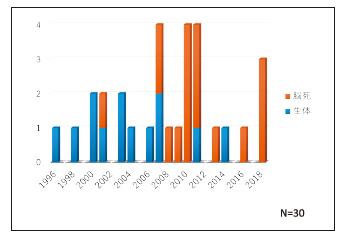
症例数
これまでに世界中で3000例以上(年間約100例)が実施されてきましたが、日本では2018年末までに17例の脳死小腸移植、13例の生体小腸移植が実施されたに過ぎません(27名の患者さんに対して30回の移植を実施)。日本での脳死小腸移植は2000年1月から登録が開始されましたが、登録者累計でも31例に過ぎず、現在の待機者は4例(うち1例は肝臓・小腸同時移植希望)のみとなっています。北海道大学病院での実施症例はなく、現在、待機患者さんもおられない状況です。
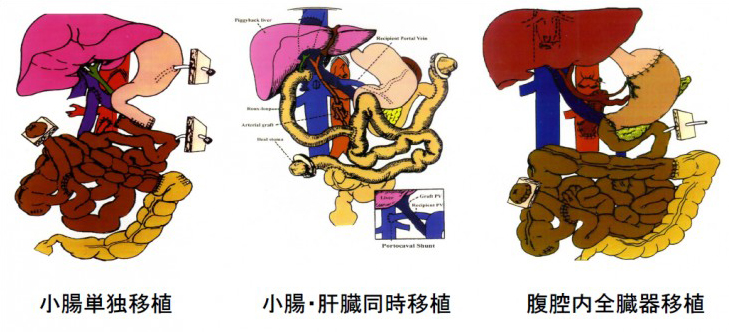
手術
手術は小腸単独の移植(左図)のほかに、傷んだ肝臓も同時に移植する小腸-肝臓同時移植(中図)や腹部の内臓をすべて置換する腹腔内全臓器移植(右図)が患者さんの状態によって選択されます。
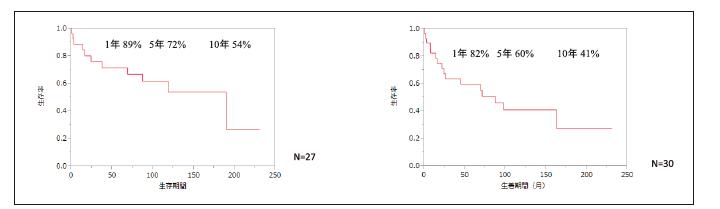
成績
北海道大学病院では適応患者さんが居らず、未実施のため成績を示すことはできません。これまでに実施された日本全国の成績では、移植された小腸が生着する移植後5年生着率60%、移植後5年生存率は72%となっています。成績は改善しているものの、他の臓器移植手術に比べ低い結果となっており、今後の改善が模索されています。
登録の手続き
脳死小腸移植を受けたいと思う施設で外来を受診し、説明を受け登録を希望される場合は登録に必要な検査を受けます。この検査データをそれまでの経過情報とともに検査した施設から「脳死小腸移植適応評価委員会」というところに送って、小腸移植が治療として妥当かどうか?実際に移植が出来るかどうか?どれくらい急ぐのか?について全国一律基準による評価を受けます。移植の適応ありと判断された場合は、急ぐ順番にStatus 1から3までの点数がつけられて評価委員会から返事が移植施設に戻ってきます。今度はその情報を移植施設から日本臓器移植ネットワークに連絡し、患者さんからの「登録料」の振込みが確認されるとコンピューターに記録され登録が完了、待機が開始になります。待機中は定期的に移植施設を受診頂き、身体の状態を確認します。体調に変化があった場合は主治医の判断で待機statusの変更を行うこともあります。待機中に状態が悪化し脳死肝移植を待てない場合は生体小腸移植が次善の策として挙げられますが、当院では実施しておらず、そのような場合は実施している施設を紹介することになります。
医療費
小腸移植に関しては、長く自費診療となっていましたが、2018年4月から保険適用となりました。手術後の外来診療も高価な免疫抑制剤を含め医療保険が適応となり、移植後も身体障害者1級が継続できることになりました。なお、脳死小腸移植では、上記の医療費とは別に、提供いただいた臓器を搬送する費用(医師の交通費など実費)と日本臓器移植ネットワークにコーディネート費用として一律10万円が必要となります。詳細はコーディネーターから説明させて頂きます。
スタッフ紹介

消化器外科Iホームページ
https://surg1.med.hokudai.ac.jp/
心臓移植部門
はじめに
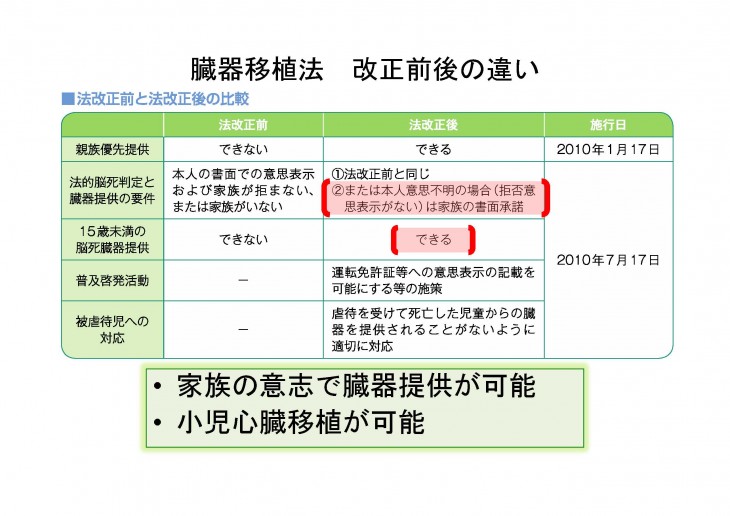
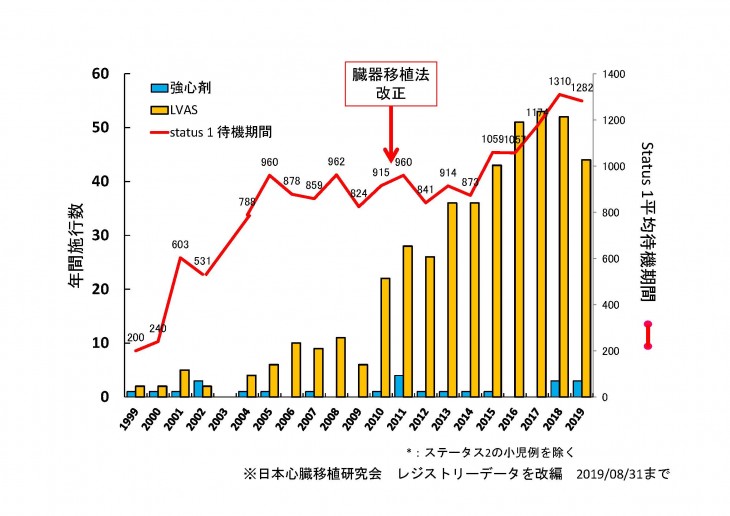
1997年に制定された臓器移植法により脳死下臓器提供が合法化され、1999年大阪大学病院にて最初の心移植が行われました。しかしながら、脳死臓器提供の条件が厳しく、国外で心移植を受ける「渡航移植」は増加傾向でした。自国内での脳死臓器移植推進を掲げたイスタンブール宣言(2008年)後、主に欧州で渡航移植を受けることが困難になりました。そこで2009年、臓器提供意思表示条件の改訂による脳死臓器提供数増加、及び15歳未満の小児からの脳死臓器提供を目的とした改正臓器移植法が成立しました(図1)
改正臓器移植法施行に合わせた心臓移植実施施設拡充に合わせ、当病院は2010年7月から心移植実施施設として活動しています。循環器内科医、循環器外科医に加え、心移植レシピエントコーディネーター(RTC)、病棟看護師、感染管理チーム、薬剤師、集中治療医、精神科医など多職種で構成された重症心不全治療チームを立ち上げ、全道から紹介される末期重症心不全患者の受け入れ・治療を行っています。また、2011年4月より植込型補助人工心臓(implantable ventricular assist device: iVAD)実施施設となり、長期化している心移植待機のために心移植適応患者に対する装着手術及び在宅心移植待機管理を行っています。
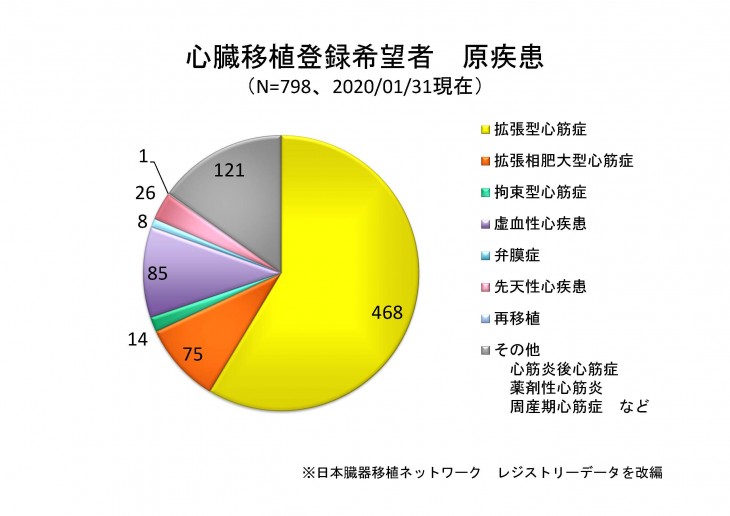
対象疾患
心移植の適応となる原疾患は多岐にわたりますが、特発性拡張型心筋症及び拡張相肥大型心筋症が約70%を占めています(図2)。その他、心筋梗塞の既往を伴う虚血性心筋症、弁膜症性心筋症、先天性心疾患、心筋炎後心筋症、抗がん剤などによる薬剤性心筋症が含まれますが、原疾患によらず内科的治療抵抗性の末期重症心不全(1年生存率約50%)の患者さんが対象となります。ただし、全ての重症心不全患者さんが心移植適応を取得し、移植待機可能ではありません。医学的条件の他、経済的条件、社会的条件など様々な視点から重症心不全治療チームで検討し、北大病院心移植適応検討委員会及び日本循環器学会心移植委員会適応検討小委員会の2段階審査を経て、公式に適応が決定されます。
移植実施数
2011年7月以降、北大病院で6例の心移植が行われました(2020年2月29日現在)。いずれの患者も、iVAD装着下に平均1116(894 – 1418)日の待機期間を経て心移植に到達しました。2011年4月より国内で、心移植待機(Bridge to Transplantation: BTT)を目的としたiVADの使用が可能になり、在宅移植待機が可能になりました。それ以前は、数年に達する装着中の入院が強いられる体外式LVADしか選択できなかった移植待機のQOLが大幅に向上しました。
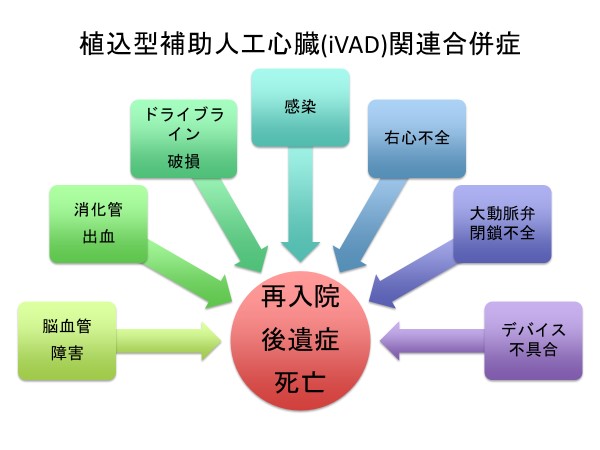
しかし、血栓症や出血性合併症、ドライブライン感染の発症頻度は少なくなく、頻回の再入院を必要とすることがあります。また、脳血管障害によるダメージが大きい場合、ADLが大きく低下し在宅移植待機が困難になる場合もあります。最低4〜5年の移植待機期間が予想される現状では、LVAD装着後に進行する大動脈弁閉鎖不全症や右心不全に対する管理・治療も大きな問題となっています(図3および4)。
待機症例数
心移植待機患者は、心不全の重症度によりステータス1と2に分けられます。ステータス1とは、より心不全が重症で濃厚な治療(VAD・PCPS・IABP・強心剤・人工呼吸)を必要とする状態で、ほとんどのステータス1の患者はiVADを装着しています。ステータス2は、それ以外の状態で主に外来通院で、慎重な心不全治療が行われている状態です。2020年3月31日現在、北大病院を移植実施施設とした待機患者は、iVAD装着下のステータス1が20数名、ステータス2が数名います。
LVAD装着患者には札幌市外在住の方もおり、居住地域の医療機関と連携し、合併症発症時の対応を中心に在宅移植待機をサポートしていただいています。その際には、当チームの心臓外科医、人工心臓管理技術認定士、レシピエント移植コーディネーターが現地へ赴き、協力医療機関や救急隊へのレクチャーを行っています。
※PCPS:経皮心肺補助 IABP:大動脈内バルーンパンピング
PCPS:経皮心肺補助
IABP:大動脈内バルーンパンピング
成績(生存曲線)
当院で移植を受けた患者は、全員生存しています。(最長移植後3年経過)国内で施行された心臓移植後の生存率は、5年生存率が約93%、10年生存率が約90%と、国際統計と比べ良好な成績です(図5)。

移植後は、拒絶反応による移植心の廃絶を防ぐため、終生の免疫抑制療法を受ける必要があります。長期間の免疫抑制療法による副作用(感染症、腎機能低下、糖尿病、脂質代謝異常、骨粗鬆症など)の発生を抑えるため、食生活や生活習慣の注意が長期に渡り必要です。また、移植後5年以降の心移植患者の死因の1位は、悪性腫瘍です(図6)。そのため、定期的な全身精査が長期間必要です。
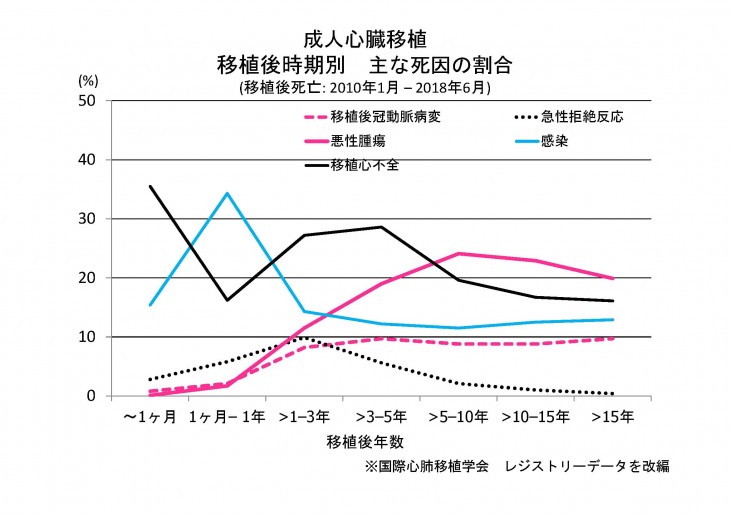
移植心に特有の合併症に、移植後冠動脈病変があり、移植後3年以降に発症が多く見られます。移植心の冠動脈に生じる、びまん性の内膜肥厚により冠動脈内腔が狭くなることで、慢性的な心筋虚血(≒心筋梗塞)が生じ心機能が低下します。動脈硬化性狭窄により生じる狭心症・心筋梗塞と異なり、病変が限局されていないため、カテーテル治療や冠動脈バイパス術による血行再建は効果が無いことが多く、再移植が必要となる場合があります。移植心は、脱神経状態のため本来自覚される狭心痛を伴わず、労作時疲労感や呼吸困難など心不全症状が先行して出現することが多いため、自覚症状や体重増加などの徴候に注意が必要です。また、通常の冠動脈造影では内膜肥厚の進行を早期から診断することは困難で、血管内超音波検査(IVUS)が早期発見に有効です。IVUSにより内膜肥厚が有意に進行していると判断された場合、mTOR阻害薬であるエベロリムス(サーティカン®)が内膜肥厚抑制に有効であるとされています。
スタッフ紹介
循環器外科ホームページ
https://www2.huhp.hokudai.ac.jp/~cardiovascular/
移植コーディネーター部門
移植コーディネーター部門には、腎臓移植担当、肝臓・消化器移植担当、心臓移植担当のレシピエント移植コーディネーターが専従で5名配置され、チームで検討を行いながら充実した支援を目指しています。
レシピエント移植コーディネーターは、移植を受けられる方(レシピエント)とそのご家族の支援を行っていますが、生体間での移植では臓器を提供する方(生体ドナー)の支援も行っています。
※当院では、移植関連学会(日本移植学会等)の認定を受け、移植に関する専門的知識と豊富な経験を持つレシピエント移植コーディネーターが道内全域にわたり活動しています。
具体的な支援内容
- 移植医療に関する情報提供を行い、最善の治療を選択できるように意思決定を支援しています。
- 移植医療(臓器移植)の全過程において、継続した生活指導や精神的支援を行っています。
- 専門的知識を活かし、医療チームの要となって、患者・家族との橋渡し的存在となり、幅広く連携・調整を行っています。


